孟加拉国防护用品准入
2020-04-28 13:13(一)监管机构
孟加拉国药品监督管理总局(Directorate General of Drug Administration,DGDA)隶属于孟加拉国卫生和家庭福利部,其职责是对医疗器械的生产、进口、销售等进行监督管理,并确保药品质量、疗效和安全,以最大程度满足国民所需。
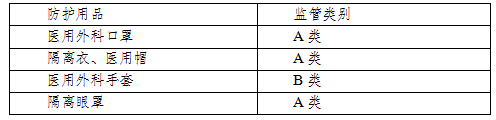
在孟加拉国,医疗器械分为A类(低风险)、B类(中低风险)、C(中高风险)、D类(高风险),根据2015年颁布的《医疗器械注册指南》,防护用品分类见表1:
表1:孟加拉国防护用品监管类别
医疗器械上市前批准程序由生产商和公告机构负责,A类产品无需从DGDA获得制造许可证,但生产商需要进行符合性声明并向DGDA报备;B、C、D类产品的设计与生产需要公告机构出具认证,生产商和进口商必须申请许可以及获得产品性能、安全方面的支持文件。
(二)法律法规
DGDA按照以下法规条例的规定来行使职权:
《药品法案,1940》;
《药品条例,1945》及其修正案;
《药品条例,1946》及其修正案;
《药品(管制)条例,1982》及其修正案;
《药物(管制)条例修正案,2006》
(三)清关流程和材料
根据2015年颁布的《医疗器械注册指南》,对于首次进口或生产的医疗器械,申请人必须在进口或生产前向DGDA申请注册。费用在申请时一并提交,注册将由DGDA签发。
注册申请须由医疗器械生产商的授权人、当地授权代理商或者外国供应商按照规定的格式向DGDA提出,对于在同一场所生产的同类医疗器械,可以用一张申请表,但不得多于5种产品,如多于5种产品,应另外进行单独申请。
对于B、C、D类产品,公告机构须首先进行质量管理体系(QMS)认证,已在孟加拉境外获得由国家监管机构/公告机构颁发的QMS认证、产品认证或者销售授权的生产商,需要将相关资料提交DGDA;对于D类产品,还需对设备的设计进行认证,再由生产商或进口商连同DGDA规定的以下文件一并提交注册:
1)本地授权代理商的姓名、地址、电话、邮箱;
2)生产商授权本地代理商代为提交申请的授权书原件。如申请是由孟加拉国当地生产商的办事处提出,则不需要;
3)负责产品上市的公司或人员的名称、地址、电话号码和邮箱,如与生产商不同,则需生产商法人的证明文件;
4)如需在孟加拉国开展部分生产活动,则需提供当地生的商的详细信息;
5)产品的品牌、设备、通用名称;
6)按照全球医疗器械协调工作组(GHTF)分类的设备类别;
7)设备详细信息和说明;
8)设备尺寸;
9)设备的主要用途;
10)设备主文件,包括结构材料和定量分析细节(仅在CE或者FDA认证不适用时提交);
11)制造过程的简短描述,可提供多设施制造的详细信息,包括制造工艺简要说明和流程图;
12)标签和包装细节;
13)使用设备时所需附件的详细信息(如适用);
14)使用的标准(以ISO、ASTM、IEC、AAMI的标准优先);
15)设备使用说明书。
另外,注册申请时还需要提供生产国和在其他发达国家的监管情况,B类产品需提供原产国出具的自由销售证明(FSC);C类和D类产品,需提供欧盟、美国、加拿大、澳大利亚和日本中任一区域或国家出具的FSC,以及原产国FSC,还必须提交的是合格评定证书或同等资历证书,以及过去2年内因任何原因发生的任何退市或进行召回的详细信息(如有)。
孟加拉国进口业务一般情况下必须以不可撤销的信用证支付。除非孟加拉国商务部特许,进口贸易均不得采用CIF方式,以保护孟加拉国保险业及运输业。孟加拉自2002年2月15日开始实施进口商品“PSI—船前检验制度”(Pre-Shipment-Inspection),对输往孟加拉国的商品在装船前实施货值评估及散装状态检验。PSI属于强制性进口管理规范,一般由孟加拉国政府签约的国际商检机构进行装船前检查。商检机构完成检验后,在货物发票、箱单上背书,进口商凭此才能输报关等进口手续。对于进口到孟加拉国的产品,货运代理商需向孟加拉国海关当局提交电子版舱单数据(包括通过船舶进口的产品的说明)。如通过卡车运输经陆路关口,应由卡车公司或司机向海关提交进口货物清单(IGM)。IGM提交以后,指定的C&F代理或进口商需完成货物申报(俗称为入境单或提单),并通过海关数据自动化系统提交货物申报。申报或提单必须以一种特定的格式输出,称为单一行政文件(SAD)。其他需要报送的资料还包括信用证、发票、提单/运输收据、装箱单、“原产国”证书、保险单、增值税/银行标识代码证书。
对于医疗器械类产品,进口关税税率在0-25%区间。上述材料提交后经由海关评估,进口商或其C&F代理支付关税和税款,完税后,海关签发通关放行单,完成口岸手续后,货物清关。
B、C、D类医疗器械在孟加拉国上市后,生产商或进口商应遵守相关监管要求。严重不良事件应在知晓事件发生后10个工作日内向DGDA的指定机构提交分析报告,并应采取适当的纠正和预防措施,以防止或降低不良事件再次发生的可能性。
(四)相关标准
截至目前,孟加拉国暂未制定医用防护用品相关国家标准。
成都市标准化研究院 编辑